內能
熱力學系統內含有的能量,但不包含因外部力場而產生的系統整體之動能與位能。內能會因系統能量的增損而隨之改變。
內能的定義
內能是一系統內的狀態函數,其值僅取決於該系統的目前狀態,而與達到此一狀態所採之途徑或過程無關。內能是個外延物理量。
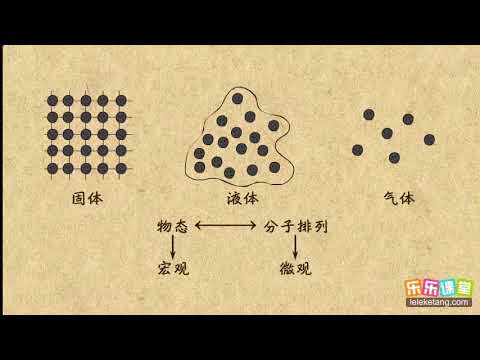

內能的微觀解釋
內能可被分為微觀位能與微觀動能兩部分。微觀位能是指化學能與核位能,以及該系統內因為內含的電偶極矩與磁偶極矩所產生的物理力場,以及固體的形變(應力-應變)所具有之能量的總和。微觀動能是該系統內所有粒子之運動的總和。
內能的變化

內能的變化量 ΔU 可寫成以下形式:
ΔU = ΔQ – W
其中:
ΔQ 是系統吸收或釋放的熱量。
W 是系統所作的功。
理想氣體的內能
理想氣體的內能可寫成只與温度有關之函數。其內能變化量為:
dU = Cv dT
Cv 是物體的定容比熱容。
結論
內能是一個重要的熱力學概念,用於描述熱力學系統的能量狀態。瞭解內能的性質和行為對理解熱力學系統的行為至關重要。
內能:探索物質熱能的奧秘
我們生活在一個充滿熱能的世界,從太陽的炙熱到冰塊的寒冷,熱能無處不在。它作為一種重要的能量形式,推動著各種物理和化學過程,也影響著我們生活的方方面面。而理解熱能的關鍵,就需要探究內能這個神秘的概念。
什麼是內能?
簡單來説,內能是指物質內部所有微觀粒子(分子、原子、電子等)的動能和勢能的總和。這些微觀粒子不斷地運動和相互作用,其動能和勢能也隨之變化。內能的大小反映了物質所具有的總能量,也是衡量物質熱狀態的一個重要指標。
內能的變化形式
內能的變化通常伴隨著熱量的吸收或釋放。當物質吸收熱量時,其內能會增加;當物質釋放熱量時,其內能會減少。同時,內能的變化也可能與物質的狀態改變有關,例如:
- 固態轉變為液態:物質需要吸收熱量才能克服分子之間的吸引力,內能增加。
- 液態轉變為氣態:物質需要吸收更多熱量才能克服分子之間的束縛,內能進一步增加。
- 氣態轉變為固態:物質釋放熱量,分子間的吸引力增強,內能降低。
內能的計算
內能的變化量(ΔU)可以用以下公式計算:
ΔU = Q - W
- Q:物質吸收或釋放的熱量
- W:物質做的功或對外界的功
內能與宏觀量之間的關係
內能與一些宏觀量(如温度、壓強、體積)之間存在著密切的關係。例如:
- 温度升高,內能增加。
- 壓強增加,內能增加。
- 體積增加,內能保持不變(理想氣體)。
內能的應用
內能的概念在許多領域都非常重要,例如:
- 化學反應:化學反應的發生通常伴隨著內能的變化,例如燃燒反應放出熱量,內能減少;分解反應吸收熱量,內能增加。
- 熱力學:熱力學是研究熱能轉化的學科,其中內能是重要的研究對象之一。
- 動力學:動力學研究物體的運動,其中內能的變化可以影響物體的運動狀態。
總結
內能是一個重要的熱力學概念,它反映了物質內部微觀粒子的能量狀態。理解內能的變化和與其他宏觀量的關係,對於我們理解物質的熱行為和許多相關的物理化學現象至關重要。
參考資料
表格:內能與温度、壓強的關係
| 温度變化 | 內能變化 |
|---|---|
| 升高 | 增加 |
| 降低 | 減少 |
| 壓強變化 | 內能變化 |
|---|---|
| 增加 | 增加 |
| 減少 | 減少 |
